Kanyú, Revista
Científica Universidad Nacional Autónoma Altoandina de Tarma
Kanyú, Revista
Científica Universidad Nacional Autónoma Altoandina de Tarma
https://revistas.unaat.edu.pe/index.php/kanyu
Volumen 2 Núm 2 pp. 17 - 38
ISSN:
2961-2748
Viabilidad e impacto del manejo de las ovas obtenidas por estimulación
hormonal de telmatobius macrostomus en la reserva nacional de Junín, Perú
Feasibility and impact of the
management of ova obtained by hormonal stimulation of telmatobius macrostomus in the national
reserve of Junín,
Perú
DOI:10.61210/kany.v2i2.90
aGalia Mavel Manyari Cervantes1 gmanyari@unaat.edu.pe
https://orcid.org/0000-0001-6797-6655
1Universidad Nacional Autónoma
Altoandina de Tarma,
Junín, Perú.
Recibido: Marzo,
2024
Aceptado: Abril, 2024
Publicado: Junio 2024

RESUMEN
Este estudio tuvo como objetivo
determinar la viabilidad y el impacto que genera el manejo de ovas artificiales de Telmatobius macrostomus en la Reserva Nacional de Junín. El método general utilizado
en la investigación fue el método científico. Obteniendo como resultados que la viabilidad de las ovas obtenidas artificialmente fue muy favorable, mostro que el total de ovas incubadas han resultado viables a excepción de las ovas
muertas que se presentaron en un minino, además los renacuajos obtenidos de esta incubación y que fueron sembrados en cinco lugares distintos de la reserva nacional de Junín, resultaron primero al obtener
una grado de significancia
de 0.000 menor a 0.005 .con diferente impactos
positivos al sembrío
de los renacuajos.
Palabras clave: Reserva Nacional, viabilidad,
impacto ambiental.
ABSTRACT
The objective of this study was to determine the viability and impact generated by the management of artificial eggs of Telmatobius macrostomus in the Junín National Reserve.
The general method used in the research
was the scientific method. The results
obtained showed that the viability
of the artificially obtained
eggs was very favorable, showing that the total number of eggs incubated were viable except
for the dead eggs that were present in
one tadpole. In addition, the tadpoles
obtained from this incubation and that
were sown in five different
places in the Junín National
Reserve, were the first to obtain
a degree of significance of 0.000 less
than 0.005, with different positive impacts on the
sowing of the tadpoles.
Key words:
National Reserve,
viability, environmental impact,
Telmatobius macrostomus
INTRODUCCIÓN
La rana gigante
de Junín Telmatobius macrostomus, es una especie endémica
de la región central del
Perú (Cerro de Pasco, Junín) sirve de alimento y para la confección de diversos accesorios. Cumple un rol importante como controlador
biológico en el equilibrio del ecosistema
de los lagos, lagunas, lagunillas, ríos, riachuelos y dentro del ambiente
humano.
La Reserva Nacional
de Junín pertenece
a la cuenca hidrográfica del río Mantaro
perteneciente a la Región Junin-Perú. Los ríos y arroyos recolectan el
agua de las zonas húmedas e
inundables y las llevan hacia los totorales periféricos. El lago que es el
principal abastecedor de agua es alimentado por 12 ríos y 20 arroyos. Algunos
de estos ríos son el río Yahuarmayo, el Maraychaca, el Condorcocha
y el Huascán. El lago tiene una
profundidad máxima de 12 metros (10
km. frente a Huayre) cuando el nivel del lago es 4,082.7 metros sobre el nivel del mar. La temperatura del lago a diferentes profundidades es: de 17°C a 15 cm., de 15,5°C a 1 m, de perte15°C a 3
m, y de 14°C a 6 m. El lago presenta una fuerte contaminación por relaves
mineros en la parte noroeste.
La descomposición de la vegetación sumergida y la descarga de aguas servidas
de los poblados
de Junín y Carhuamayo, disminuyen la cantidad de oxígeno disponible y adicionan fósforo. Dentro
de esta extensa reserva natural
existen especies endémicas que conforman un ecosistema muy variado con especies de peces nativos,
anfibios, mamíferos y aves autóctonas y migratorias (sitio
RAMSAR).
-Dentro las diversas especies de anfibios destaca la rana gigante de
Junín (T.macrostomus), un anfibio
endémico de la región central de nuestro territorio importante para el
equilibrio del Ecosistema de esta
reserva. Tradicionalmente, la rana gigante de Junín ha sido utilizada como fuente
de alimento y para la fabricación de diversos accesorios, por lo cual se encuentra en peligro de extinción. Además, las ranas en desarrollo son
particularmente sensibles a la contaminación
química que se acumula en ríos, lagos y lagunas. (Durham, 2001). Para su conservación primero fue necesario lograr
que T. macrostomus se adapte al cautiverio. Se
realizó con éxito la estimulación hormonal a la reproducción por lo
cual en este trabajo nos propusimos
averiguar; ¿Cómo es la viabilidad y el impacto
del manejo de las ovas obtenidas por
estimulación hormonal de T. macrostomus en la
Reserva Nacional de Junín, Perú? El objetivo fue determinar la viabilidad y el impacto
que genera el manejo de ovas de
T. macrostomus en la Reserva
Nacional de Junín.
Antecedentes
La Reserva Nacional de Junín está constituido por
53,000 Has, declarada en emergencia ambiental
en el año 2002 por la Ley 27642. Continúa en la misma categoría de peligro después de dos años. El lago Junín,
también conocido como Chinchaycocha, presenta una fuerte contaminación por relaves mineros en la parte noroeste. A
4,100 msnm, el suelo del Lago, que
cubre la mayor porción del área protegida, está contaminado en un 80% por metales pesados. De acuerdo con Castillo
(2001) el suelo del lago contiene hierro, cobre, cadmio, mercurio, arsénico y plomo en valores superiores a los máximos permisibles. El
lago Junín es un cuerpo de agua en proceso de eutrofización y en esta situación
cualquier adición de compuestos nitrogenados acelera la sucesión. La descomposición de la vegetación sumergida y la descarga de aguas servidas de los poblados de Junín y Carhuamayo disminuyen la cantidad de oxígeno disponible y adicionan fósforo. En el
centro del lago, debido a la profundidad
y mayor aireación, hay más oxígeno. El nitrógeno amoniacal también aumenta por la materia orgánica que se
descompone en el fondo. Es por esto que la descarga de las aguas servidas representa un serio
problema en la conservación del lago. La cantidad de hierro y la turbidez es, de manera evidente, mayor en el sector
del puente Upamayo como resultado de
la acumulación de los relaves de las minas. Esta mayor cantidad de hierro explica también, la menor cantidad de
oxígeno disuelto en el sector (a mayor presencia de hierro menos oxígeno disuelto). El pH tiende a ser menor, aunque
se encuentra cerca de la neutralidad.
Esto es notable en la época seca, más aún en las temporadas de sequía. Esta reserva es considerada como una de las
zonas de conservación más importantes del Perú en lo que se refiere a diversidad de aves alto andinas que
habitan en un mismo ecosistema. Sin embargo,
su especie representativa, el Zambullidor de Junín (Podiceps taczanowskii), se encuentra a punto de desaparecer. El
último censo de hace dos años confirmó la existencia de tan sólo 160 aves de esta especie (Durham, 2001).
Al igual que el zambullidor, la rana Gigante de Junín
“Telmatobius macrostomus”, especie
endémica de esta región y anfibio símbolo de la reserva Nacional de Junín por
su alto valor nutritivo y sabor
agradable.La contaminación de su hábitat y su sobreexplotación la colocaron en peligro crítico
de extinción a nivel mundial.
La biotecnología puede
proveer los medios y técnicas
para propiciar el desarrollo de especies de anfibios y peces de manera artificial, como lo son; el control
temporal de la maduración, el control de la fertilidad, el control
del sexo genético
y el control de la proporción de sexos en la progenie
(Díaz, 2005). Aguilar et.al (2009) estudiaron los aspectos reproductivos de especies de Ambystoma que son vitales para la conservación, logrando
reproducir a la especie en condiciones de laboratorio de manera natural
o espontánea, o por la estimulación hormonal
con Gonadotropina Coriónica (hCG). Se realizó una inducción
de ovulación y fertilización in vitro en Bufo
marinus cuyo objetivo fue diseñar un protocolo de manejo reproductivo en
B. marinus, utilizando altas dosis de
HCG Pregnyl y logrando cadenas de óvulos y renacuajos durante 65 días. (Uipan, et al., 2003). Otros
estudios ya habían señalado que ranas anormales tenían concentraciones significativamente menores de andrógenos
(hormonas sexuales) y de una hormona cerebral
llamada hormona liberadora de gonadotropinas (GnRH)
con respecto a las ranas normales. Estos hallazgos sugieren
que puede haber interacciones significativas entre los factores ambientales y endocrinólogos durante
el desarrollo de las larvas de anfibios
que afecten procesos
diferentes, incluyendo la reproducción y el desarrollo de las extremidades (Durham, 2001).
Con el objetivo de sacar a la rana Gigante de Junín del peligro de extinsión , se logró
adaptar esta especie al cautiverio y reproducirla por estimulación hormonal con gonadotropina corionica humana (GCH) en diferentes
dosis y con resultados positivos en la obtención de ovas que logren adaptarse a su hábitat natal que es la reserva
Nacional de Junín, con la introducción
de renacuajos inducidos con GCH. Este problema es en realidad alarmante puesto
que no solo se visualiza la extinción de la Rana Gigante de Junín sino también de otras especies de anfibios endémicos
de la región Central del Perú, todo gracias a la destrucción y contaminación del hábitat que pone en riesgo la existencia de
toda la fauna e incluso de las
poblaciones humanas. El Perú con 315 especies de anfibios registrados, se
encuentra en cuarto lugar a nivel
mundial, después de tres países neotropicales como Brasil, Colombia y Ecuador (Rodriguez et, al. 1993)
Se estima que 301 especies de fauna silvestre están
amenazadas por la pérdida de su hábitat, tráfico ilícito y cacería furtiva (Durham, 2001).
Esta investigación abarca dos conceptos
fundamentales; i) la viabilidad de las ovas, la cual es determinada como los huevos vivos que generan renacuajos
y futuras ranas, y ii) el impacto
ambiental en la Reserva Nacional de Junín, los cambios positivos o negativos
que se dan en el entorno ambiental de
la Reserva. La rana gigante de Junín es un anfibio muy promisorio a nivel del Perú, por su importancia biológica, medicinal, económica e industrial. Sin embargo
es una especie según
la legislación peruana vigente en vías de extinción.
Género Telmatobius
Está distribuido en un hábitat que se generaliza en
los lagos, lagunas y lagunillas, ríos, riachuelos
ubicados en los andes de los departamentos de Junín y Cerro de Pasco, cuyas altitudes oscilan entre los 3 300 a 4 600
msnm se les denomina comúnmente ranas de Junín
y se alimentan preferentemente de Orestias y Pigidium, pequeños
moluscos, helmintos e insectos y
porciones tiernas de plantas acuáticas del género chara y Myriophyllus , esta especie
es comestible con importantes constantes bromatológicas que les confiere una buena cotización en el mercado nacional e
internacional. (Bedriñana 2000)
La rana gigante de Junín al igual que en la mayoría
de anfibios sufren cambios sexuales debido
a determinados estímulos ambientales y hormonales, o cuando ellos de acuerdo a
su población sienten la necesidad
de que uno de los sexos de desarrolle más con respecto al número de individuos generalmente en cambio se da de machos a hembras.
(Tovar, 2006)
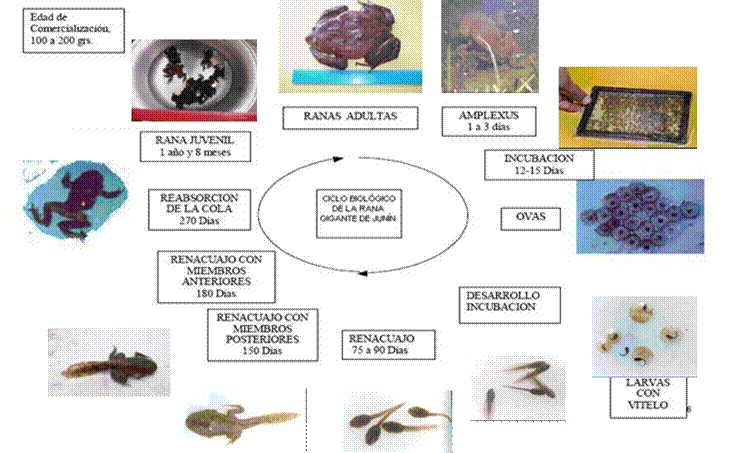
En los Anuros, la fecundación es externa y verificada
por el macho durante el amplexus (figura 1) dentro
del agua, al mismo tiempo
y a medida que las hembras realizan
la postura de los
huevos. La fertilización comprende un doble proceso: primero la activación o
iniciación del desarrollo del huevo, realizada normalmente por la penetración
del espermatozoide de la misma especie, pero que,
experimentalmente, puede provocarse por varios agentes partenogenéticas (físicos o químicos, como la picadura
con un alfiler de la membrana vitelina,
o la acción del agua destilada, o la solución
de Ringer, exenta
de Ca, y un pH de 7,5 a 10,2)
(3) y segundo la anfinixis, o unión y fusión (singamia) de los dos pronúcleos y que contienen
las potencialidades hereditarias (nucleares y cromosomales). La prueba
más visible de la activación y que
puede observarse en el huevo de rana con ayuda de una lente (3), es la elevación
o separación de la membrana
vitelina (o membrana
de fertilización) y contracción del huevo apareciendo ambos, huevo y
membrana, separados por una capa líquida (líquido perivitelino) dentro de la cual el huevo es libre de rodar por
la acción de la gravedad, apareciendo
arriba el polo animal y en la parte inferior el polo vegetal. En el huevo de
rana artificialmente inseminado, la
rotación es completa una hora después de la inseminación tercero, otra consecuencia de la penetración del espermatozoide,
es el hinchamiento de la cubierta
gelatinosa hasta su grado máximo; puede observarse con pequeño aumento, contra un fondo oscuro, que, a los 5 minutos la
imbibición es de un 30%; a los 15 minutos de casi 75 %, y después continúa el hinchamiento más lentamente. Esta
capa gelatinosa tiene una gran importancia, proporcionando al huevo
una eficaz protección contra la ingestión o lesión por organismos mayores, o las infecciones
por hongos o seres inferiores; ayuda al huevo a conservar su propio
calor, desarrollado metabólicamente, por actuar como aislante del calor. Antiguamente se suponía, erróneamente, que actuaba como una lente concentrando los rayos del sol dentro del huevo (Puente, 1990).
Figura N° 1
Ciclo Biológico de B. macrostomus , tomado de Bedriñana (1999)
|
|
 |
La Reserva Nacional de Junín (RN Junín), considerada
como Humedal de Importancia Internacional,
especialmente como Hábitat de Aves Acuáticas (Sitio RAMSAR), viene atravesando por una serie de problemas que
están causando malestar entre los habitantes de la zona. Teniendo en cuenta este aspecto y en respuesta
a las necesidades de información que ayuden a los tomadores
de decisiones a cumplir con los objetivos
de creación de la Reserva, se identificó un juego de 24
indicadores para monitorear los procesos de conservación que se lleven a cabo en este lugar. Los indicadores fueron elegidos tomando
en cuenta las metas y objetivos socialmente determinados y las características que presenta el ecosistema, con la finalidad de evaluar el estado, presión,
impacto y respuesta de las actividades humanas sobre los recursos y servicios más importantes
de esta Área Natural Protegida. A través de este trabajo se pretende dar a conocer una metodología que permita un
efectivo acercamiento de la
sociedad a los procesos de monitoreo, en el marco del manejo adaptativo de
ecosistemas, resaltando los valores sociales
sin dejar de lado el rigor científico de los parámetros ambientales. (Manyari, 2012)
Problemática Ambiental
El Ing. Elvis Pineda, Gerente General de la
consultora y asesora ambiental ECOMUL SAC y especialista en desarrollo rural y ecología,
explica que los vestigios se encuentran en condición de contaminación pasiva. En
los meses sin lluvia (septiembre, octubre y noviembre) los sedimentos contaminan la atmósfera, suelos,
pastos naturales y viviendas de las zonas pobladas. Durante la
temporada de lluvias, la crecida del Río San Juan lava su cauce de los sedimentos de hidróxido de
fierro hacia el Lago Junín. El factor principal que agrava la contaminación e imposibilita la solución de este
complejo problema ambiental es la
represa de Upamayo, situada en el delta de Upamayo, donde nace el efluente del
Lago de Junín: el Río Mantaro. La represa es la fuente de energía para la
hidroeléctrica de la zona. Sin embargo,
desde su creación
los índices de contaminación en los suelos
y desaparición de especies
han aumentado. Y es que cuando se llena la represa -al cerrar sus compuertas
para la temporada sin lluvia-
no sólo fluye más el cauce del río que lleva consigo
el hidróxido de fierro,
sino también las especies de aves no llegan a reproducirse. Al elevarse el
nivel del agua, los nidos se inundan y pierden la oportunidad de procrear hasta el año siguiente cuando
se repite la misma situación. (Vera, 2004)
En este sentido se planteó la pregunta de investigación ¿Cuál es la
viabilidad y el impacto que genera el manejo de las ovas de T. macrostomus obtenidas artificialmente (por estimulación hormonal)
en la Reserva Nacional de Junín? cuyo objetivo fue la de determinar si la estimulación hormonal con
Gonadotropina Corionica Humana (hCG) influye en la reproducción de la rana gigante de Junín en cautiverio,
estableciendo la dosis correcta y parámetros de reproducción de la rana Gigante de Junín en cautiverio además
de determinar la viabilidad y el impacto
que genera el manejo de ovas artificiales de T. macrostomus en la Reserva
Nacional de Junín.
METODOLOGÍA
El tipo de investigación por su naturaleza está
enmarcado dentro del tipo de estudio aplicado en razón a que esta se orienta
a aportar información básica que se nos da al obtener
la viabilidad de las ovas obtenidas artificialmente (por estimulación hormonal)
y a la vez verificar el impacto que genera la introducción de los renacuajos obtenidos de esta viabilidad dentro
de la Reserva Nacional
de Junín (Yarlequé, 2004)
La investigación en razón a la naturaleza de las
variables y su contrastación ulterior es experimental
en razón de poner a prueba la viabilidad de las ovas obtenidas artificialmente desarrollada “in vivo”, con animales vivos
en cautiverio y verificar el impacto que genera la introducción de los renacuajos en la Reserva
Nacional de Junín.
(Yarlequé, 2004)
El método a emplearse será de tipo experimental
dándose el diseño de investigación descriptivo
explicativo, las muestras serán tomadas en conjunto el total de ovas obtenidas artificialmente y el impacto será
verificado con los renacuajos obtenidos de la viabilidad de las ovas
dentro de la Reserva Nacional de
Junín.
Las ovas obtenidas artificialmente por estimulación
hormonal en un aprueba anterior fueron
un total de 8776 ovas en aparente buen estado, las cuales fueron mantenidas
durante el tiempo que duro las pruebas,
en 20 bastidores especiales construidos con bordes de madera y nilón de algodón en artesas de fibra de vidrio, cada bastidor con un promedio
de 439 ovas, bajo condiciones de ambiente similares a los ambientes
naturales de la Reserva nacional
de Junín, con agua corriente a una temperatura de 5 °C , en continuo
manejo de limpieza y volteo para evitar el ingreso de hongos u otros factores
que alteren el desarrollo de las ovas.
La incubación de las ovas se desarrolló durante 21
días, que es el tiempo normal en un ambiente
natural de incubación de una ova de esta especie entonces, dándoles condiciones lo más naturales posibles a fin de
determinar la viabilidad de cada una de ellas con la obtención de renacuajos de primer estadio
saludables y con buenos reflejos
al contacto y que comenzaron a aceptar alimento.
Se procedió al sembrío de 1500 renacuajos en cada lugar determinado por un previo análisis de agua, y de biodiversidad
porque una vez sembrados los renacuajos no se pueden alimentar en forma artificial sino que cada uno busca su
propio alimento natural entonces los
5 lugares designados fueron: 1) bordes del lado sur del lago Chinchaycocha, 2)
borde del lado este del lago
Chinchaycocha el cual es el principal cuerpo de agua y hábitat natural de esta especie,
3) Rio Chacachipa ubicado al lado sur, 4) Rio Huayre ubicado
al lado este del lago y 5) Rio Huarmipuquio ubicado al lado oeste el
lago, en un promedio de 300 renacuajos por lugar, no se procedió a sembrar en más lugares de la reserva porque parte del lado norte del lago Chinchaycocha se encuentra contaminado por el relave minero de la
empresa metalúrgica Volcán (Cerro de Pasco), los renacuajos restantes quedaron
en el Centro experimental para su monitoreo
y adaptación al cautiverio.
Toda la investigación es de diseño clásico
experimental con una muestra puesto que básicamente
no se tiene información valida ni científica acerca de la viabilidad de las
ovas obtenidas por estimulación
hormonal de esta especie con ningún tipo de hormona y sobre todo en cautiverio, además de datos de renacuajos
sembrados en ambientes
naturales y su impacto ambiental.
Ovas viables de “Rana Gigante de Junín “Telmatobius
macrostomus, Anura, Familia Leptodactylidae,” obtenidas artificial, y los renacuajos que se obtuvieron de esta incubación. Además 8776 Ovas obtenidas por estimulación hormonal en una
prueba de investigación preliminar a
esta, se incubaron en 20 bastidores que se acoplaron a 5 artesas, todas con la misma calidad de agua de incubación con
una temperatura de 5 a 10 °C proveniente del
manantial de Huayre, y sometidas a la misma manipulación durante
los 21 días de incubación.
Al finalizar este proceso de incubación se procedió a
sembrar un promedio de 7500 renacuajos
los 5 lugares distintos de la reserva nacional de Junín a fin de monitorear su impacto,
los demás renacuajos quedaron para su control en el Centro
experimental de crianza
de renacuajos de Huayre.
Para esta investigación se utilizó la observación
desde su incubación en los bastidores desarrollados a fines del mes de febrero y del mes de
setiembre se inicia el proceso de ovogénesis observándose ovocitos previtelogenéticos (estadios
1 y 2); continuando el número de ovocitos con vitelogénesis temprana
(estadios 3 y 4), incrementándose el tamaño y acumulación de vítelo en el
citoplasma; en febrero y marzo se observaron ovocitos vitelogénicos en estadio
5 y de ovocitos preovulatorios en estadio 6, alcanzando un diámetro promedio
de 2000mm, el cual corresponde al tamaño del huevo cuando se realiza
la ovoposición
Materiales de laboratorio: se utilizaron un
aproximado de dos Estetoscopios para la observación
de los óvulos y la viabilidad diaria de los mismos, Placas petri para poder manipular las muestras, un juego de
pinzas, para la manipulación de las ovas, jeringas y pipetas para la
limpieza, y fichas de observación.
Figura N° 2
Ubicación de la Reserva Nacional
de Junín- Provincia
de Junín.
Fuente: Caro, C. & Quinteros, Z. & Mendoza,
V. Año: 2007.
Cuadro N° 1:
Inicio de incubación en 20 bastidores
|
Total de ovas obtenidas por estimulación hormonal: 8776
|
|
N° Bastidores
|
1
|
2
|
3
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
|
N° Ovas a incubar
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
Presenta la forma
como se distribuyó el número
total de ovas obtenidas en un estudio
anterior por estimulación hormonal en 20 bastidores para su incubación y el desarrollo de su viabilidad controlada en cautiverio.
Cuadro N° 2:
Viabilidad de ovas por día
|
Número de bastidores
|
|
|
Día
|
1
|
2
|
3
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
11
|
12
|
13
|
14
|
15
|
16
|
17
|
18
|
19
|
20
|
|
1
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
439
|
|
2
|
437
|
436
|
437
|
437
|
439
|
436
|
436
|
437
|
439
|
436
|
437
|
439
|
436
|
439
|
437
|
436
|
439
|
439
|
437
|
436
|
437
|
|
3
|
435
|
436
|
435
|
435
|
438
|
436
|
436
|
435
|
438
|
436
|
435
|
432
|
436
|
438
|
435
|
436
|
438
|
438
|
435
|
436
|
435
|
|
4
|
430
|
433
|
430
|
430
|
438
|
433
|
433
|
430
|
438
|
433
|
430
|
430
|
433
|
438
|
430
|
433
|
438
|
438
|
430
|
433
|
430
|
|
5
|
429
|
433
|
429
|
429
|
438
|
433
|
433
|
429
|
438
|
433
|
429
|
430
|
433
|
438
|
429
|
433
|
438
|
438
|
429
|
433
|
429
|
|
6
|
428
|
430
|
428
|
428
|
436
|
430
|
430
|
428
|
436
|
430
|
428
|
428
|
430
|
436
|
428
|
430
|
436
|
436
|
428
|
430
|
428
|
|
7
|
422
|
430
|
422
|
422
|
435
|
430
|
430
|
422
|
435
|
430
|
422
|
426
|
430
|
435
|
422
|
430
|
435
|
435
|
422
|
430
|
422
|
|
8
|
420
|
430
|
420
|
420
|
436
|
430
|
430
|
420
|
436
|
430
|
420
|
426
|
430
|
436
|
420
|
430
|
436
|
436
|
420
|
430
|
420
|
|
9
|
420
|
420
|
420
|
420
|
430
|
420
|
420
|
420
|
430
|
420
|
420
|
424
|
420
|
430
|
420
|
420
|
430
|
430
|
420
|
420
|
420
|
|
10
|
419
|
418
|
419
|
419
|
430
|
418
|
418
|
419
|
430
|
418
|
419
|
424
|
418
|
430
|
419
|
418
|
430
|
430
|
419
|
418
|
419
|
|
11
|
416
|
418
|
416
|
416
|
430
|
418
|
418
|
416
|
430
|
418
|
416
|
422
|
418
|
430
|
416
|
418
|
430
|
430
|
416
|
418
|
416
|
|
12
|
416
|
416
|
415
|
416
|
430
|
416
|
416
|
416
|
430
|
416
|
416
|
422
|
416
|
430
|
416
|
416
|
428
|
430
|
416
|
416
|
416
|
|
13
|
415
|
416
|
415
|
415
|
425
|
415
|
416
|
415
|
425
|
416
|
415
|
420
|
416
|
425
|
415
|
416
|
426
|
425
|
415
|
416
|
415
|
|
14
|
415
|
410
|
414
|
415
|
425
|
410
|
410
|
415
|
425
|
410
|
415
|
418
|
410
|
425
|
415
|
410
|
425
|
425
|
415
|
410
|
415
|
|
15
|
410
|
410
|
412
|
410
|
420
|
410
|
410
|
410
|
420
|
410
|
410
|
416
|
410
|
420
|
410
|
410
|
420
|
418
|
410
|
410
|
410
|
|
16
|
410
|
408
|
412
|
410
|
420
|
406
|
408
|
410
|
420
|
408
|
410
|
416
|
408
|
420
|
410
|
408
|
420
|
418
|
410
|
408
|
410
|
|
17
|
408
|
408
|
410
|
408
|
418
|
406
|
408
|
408
|
418
|
408
|
408
|
412
|
408
|
418
|
408
|
408
|
418
|
418
|
408
|
408
|
408
|
|
18
|
406
|
408
|
406
|
406
|
418
|
406
|
408
|
406
|
418
|
408
|
406
|
412
|
408
|
418
|
406
|
408
|
418
|
418
|
406
|
408
|
406
|
|
19
|
406
|
402
|
405
|
406
|
416
|
402
|
402
|
406
|
416
|
402
|
406
|
410
|
402
|
416
|
406
|
402
|
416
|
415
|
406
|
402
|
406
|
|
20
|
404
|
400
|
404
|
404
|
416
|
400
|
400
|
404
|
416
|
400
|
404
|
400
|
400
|
410
|
404
|
400
|
416
|
415
|
404
|
400
|
404
|
|
21
|
392
|
398
|
400
|
402
|
410
|
400
|
398
|
402
|
410
|
398
|
402
|
390
|
398
|
400
|
402
|
398
|
408
|
408
|
402
|
398
|
392
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Continuando los objetivos
de la investigacion objetivo de esta investigación que nos llevó a verificar
el impacto que genera el manejo de ovas al obtener renacuajos de T. macrostomus en la Reserva
Nacional de Junín,
para esto se sembró un número determinado de renacuajos de primer estadio
en cinco lugares
de la reserva Nacional de Junín
(1) bordes del lado sur del lago Chinchaycocha, 2) borde del lado este del lago
Chinchaycocha perteneciente a la Reserva Nacional
de Junín el cual es el principal cuerpo de agua y hábitat
natural de esta especie, 3) Rio Chacachi-
pa ubicado al lado sur, 4) Rio Huayre ubicado
al lado este del lago y 5) Rio Huarmipuquio ubicado al lado oeste el lago, obteniendo los resultados que se presentan a continuación.
CUADRO N° 3:
Número de renacuajos sembrados
en 5 lugares y monitoreados durante 1 año.
|
|
Lugar
|
|
|
|
1
|
2
|
3
|
4
|
5
|
|
Enero
|
300
|
300
|
300
|
300
|
300
|
|
Febrero
|
100
|
100
|
180
|
180
|
250
|
|
Marzo
|
80
|
90
|
90
|
150
|
150
|
|
Abril
|
80
|
90
|
90
|
150
|
150
|
|
Mayo
|
70
|
70
|
70
|
120
|
140
|
|
Junio
|
70
|
70
|
70
|
120
|
130
|
|
Julio
|
60
|
70
|
70
|
110
|
130
|
|
Agosto
|
60
|
40
|
40
|
100
|
120
|
|
Setiembre
|
50
|
40
|
40
|
100
|
120
|
|
Octubre
|
40
|
20
|
20
|
90
|
100
|
|
Noviembre
|
30
|
10
|
10
|
90
|
100
|
|
Diciembre
|
10
|
10
|
10
|
80
|
100
|
1) bordes del lado sur del lago
Chinchaycocha, 2) borde
del lado este
del lago Chinchaycocha perteneciente a la Reserva Nacional
de Junín el cual es el principal cuerpo de agua y hábitat
natural de esta especie, 3) Rio Chacachipa ubicado al lado sur, 4) Rio Huayre ubicado al lado este del
lago y 5) Rio Huarmipuquio ubicado al lado oeste el lago
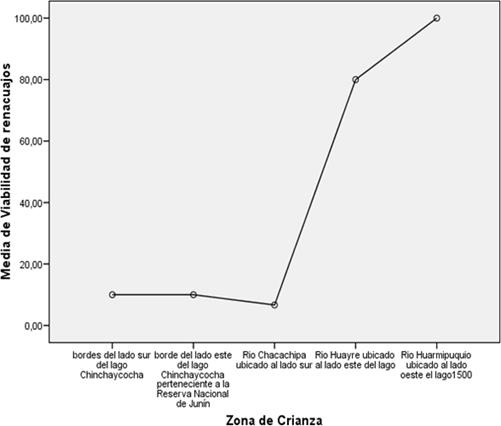
CUADRO N° 4:
Resultados descriptivos de la Viabilidad de renacuajos
|
|
N
|
Media
|
Desviación típica
|
Error típico
|
|
Bordes del
lado sur del lago Chinchaycocha
|
3
|
10
|
1
|
0.57735
|
|
Borde del lado este del lago Chinchaycocha
perteneciente a la Reserva Nacional de Junin.
|
3
|
10
|
1
|
0.57735
|
|
Rio Huayre ubicado al lado este del lago
|
3
|
80
|
1
|
0.57735
|
|
Rio Huarmipuquio ubicado
al lado oeste del lago 1500.
|
3
|
100
|
1
|
0.57735
|
|
Total
|
15
|
41.333
|
41.71616
|
10.77107
|
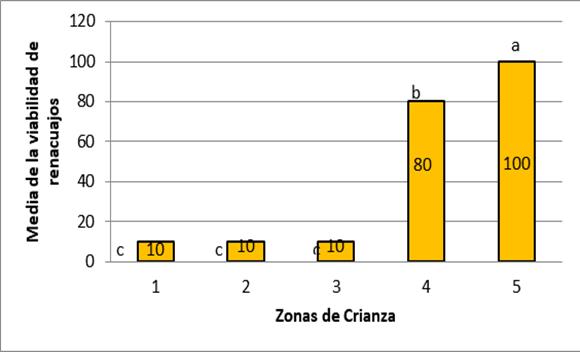
CUADRO N° 5:
Prueba de medias (ANOVA)
de la Viabilidad de Renacuajos en 5 lugares.
|
|
Suma de
cuadrados
|
gl
|
Media
cuadrática
|
F
|
Sig.
|
|
Inter-grupos
|
24306.667
|
4
|
6076.667
|
1072.353
|
0
|
|
Intra-grupos
|
56.667
|
10
|
5.667
|
|
|
|
Total
|
24363.333
|
14
|
|
|
|
CUADRO N° 6:
Prueba de comparaciones múltiples
de Tukey.
|
(I) Zona de Crianza
|
(J) Zona de Crianza
|
Diferencia de medias (I-J)
|
Error típico
|
Sig.
|
Intervalo de confianza al 95%
|
|
Límite superior
|
Límite inferior
|
|
Bordes del lado
sur del lago Chinchaycocha
|
borde del lado este del lago Chinchaycocha
|
0
|
1.94365
|
1
|
-6.3967
|
6.4
|
|
Rio Chacachipa ubicado al lado sur
|
3.33333
|
1.94365
|
0.467
|
-3.0634
|
9.73
|
|
Rio Huayre ubicado al lado este del lago
|
-70.00000(*)
|
1.94365
|
0
|
-76.397
|
-64
|
|
Rio Huarmipuquio ubicado al lado oeste el lago1500
|
-90.00000(*)
|
1.94365
|
0
|
-96.397
|
-84
|
|
Borde del lado
este del lago Chinchaycocha
|
bordes del lado sur del lago Chinchaycocha
|
0
|
1.94365
|
1
|
-6.3967
|
6.4
|
|
Rio Chacachipa ubicado al lado sur
|
3.33333
|
1.94365
|
0.467
|
-3.0634
|
9.73
|
|
Rio Huayre ubicado al lado este del lago
|
-70.00000(*)
|
1.94365
|
0
|
-76.397
|
-64
|
|
Rio Huarmipuquio ubicado al lado oeste el lago1500
|
-90.00000(*)
|
1.94365
|
0
|
-96.397
|
-84
|
|
Rio Chacachipa ubicado al lado sur
|
Bordes del lado sur del lago Chinchaycocha
|
-3.33333
|
1.94365
|
0.467
|
-9.73
|
3.06
|
|
Borde del lado este del lago Chinchaycocha
|
-3.33333
|
1.94365
|
0.467
|
-9.73
|
3.06
|
|
Rio Huayre ubicado al lado este del lago
|
-73.33333(*)
|
1.94365
|
0
|
-79.73
|
-67
|
|
Rio Huarmipuquio ubicado al lado oeste el lago1500
|
-93.33333(*)
|
1.94365
|
0
|
-99.73
|
-87
|
|
Rio Huayre ubicado al lado este del lago
|
Bordes del lado sur del lago Chinchaycocha
|
70.00000(*)
|
1.94365
|
0
|
63.6033
|
76.4
|
|
Borde del lado este del lago Chinchaycocha
|
70.00000(*)
|
1.94365
|
0
|
63.6033
|
76.4
|
|
Rio Chacachipa ubicado al lado sur
|
73.33333(*)
|
1.94365
|
0
|
66.9366
|
79.7
|
|
Rio Huarmipuquio ubicado al lado oeste el lago1500
|
-20.00000(*)
|
1.94365
|
0
|
-26.397
|
-14
|
|
Rio Huarmipuquio ubicado al lado oeste el lago 1500
|
bordes del lado sur del lago Chinchaycocha
|
90.00000(*)
|
1.94365
|
0
|
83.6033
|
96.4
|
|
borde del lado este del lago Chinchaycocha
|
90.00000(*)
|
1.94365
|
0
|
83.6033
|
96.4
|
|
Rio Chacachipa ubicado al lado sur
|
93.33333(*)
|
1.94365
|
0
|
86.9366
|
99.7
|
|
Rio Huayre ubicado al lado este del lago
|
20.00000(*)
|
1.94365
|
0
|
13.6033
|
26.4
|
*La diferencia de medias
es significativa al nivel .05.
Gráfico N° 1:
Viabilidad de renacuajos en diferentes zonas de la reserva Nacional
de Junín, mostrando el punto más favorable para el desarrollo de renacuajos productos de la viabilidad de ovas en las cinco zonas distribuidas en la Reserva
Gráfico N° 2:
Distribución de los renacuajos dentro de la reserva Nacional
de Junín, mostrándonos cuales son los puntos más favorables y que
generan mayor impacto ambiental
De acuerdo a los antecedentes obtenidos en investigaciones afines a esta (Manyari, 2012)
y a las experiencias personales en campo, las ovas de peces, anfibios
y reptiles obtenidas
por estimulación hormonal se
tornan poco viables y poco manejables por ser demasiado sensi- bles a los cambios bruscos
de temperatura y presión, lo que no sucedió en esta investigación ya que tuvo un especial
cuidado en el manejo de estas ovas a fin de obtener
la mayor cantidad
de ovas viables y por consiguiente un elevado número de renacuajos
Se tiene conocimiento que el lago Junín principal abastecedor de agua y gestor
de la bio- diversidad de la
reserva Nacional de Junín está siendo contaminado por empresas mineras pertenecientes a la región Cerro de Pasco
(Manyari, 2012), al monitorear el impacto del
sembrío de renacuajos obtenidos de la viabilidad de estas ovas verificamos su adaptabilidad y los lugares dentro de la reserva que son más aptos para que esta especie logre sobrevivir
y evitar su extinción estos sitios son
el Rio Huayre ubicado al lado este del lago y el Rio Huarmipuquio ubicado al lado oeste el lago
mostrados impactando favorablemente a la re-
serva Nacional de Junín
Manyari el año 2011 obtuvo por estimulación hormonal con Gonadotropina Corionica Humana
(hCG) la reproducción de la rana gigante de Junín en cautiverio, así como Estable-
cer la dosis correcta y parámetros de reproducción de la rana Gigante de Junín en cautiverio en Centro Experimental de crianza de
renacuajos de Huayre- módulo II, dándonos
la base de esta investigación y asegurándonos un numero de ovas que nos generaron renacuajos
utilizados los distintos puntos
de la Reserva Nacional de Junín y determinando su impacto
Chocano el 2005 nos hace referencia a que el
represamiento de las aguas, la deforesta- ción,
la agricultura y urbanismo así como la introducción de especies exóticas son
algunos de los problemas más
frecuentes y difíciles de controlar que enfrentan las aguas continenta- les mundiales y que están ocasionando el declive de muchas especies
nativas la cual nos fue muy
determinante en el impacto que estos nos generan en la Reserva Nacional de
Junín y sobre todo en la Rana Gigante de Junín muy susceptible a los mencionados.
Durha el año 2001, menciona que “El crecimiento y
desarrollo normal de los jóvenes de anfibios
dependen de sistemas acuáticos saludables. Las ranas en desarrollo son
particular- mente sensibles a la
contaminación química que se acumula en ríos, lagos y lagunas, y esto lo pudimos observar
en los distintos puntos de la Reserva
Nacional de Junín con la evolución de los
renacuajos sembrados y el impacto
que estos generaron.
También Díaz el
año 2005 nos recuerda que la biotecnología puede proveer los medios para incrementar la intensidad y capacidad
de la acuicultura para aumentar en varias veces su producción en los próximos años En animales, los principales
objetivos al manejarla re- producción
y que se pueden lograr a través de biotecnologías reproductivas son el control temporal de la maduración, pero esto tiene
que ser bien controlado porque de lo contrario
podría existir un descontrol de especies en determinados lugares
que causen impactos
nega- tivos sobre todo
en reservas Naturales como la reserva nacional de Junín.
Manyari el 2011 menciona que la Reserva
Nacional de Junín considerada como Humedal de Importancia Internacional, viene
atravesando por una serie de problemas que están cau- sando malestar entre los habitantes de la zona.
Teniendo en cuenta
este aspecto y en respues-
ta a las necesidades de información que ayuden a los tomadores de decisiones a cumplir con los objetivos de creación de la Reserva,
y en nuestro trabajo se consiguió obtener
un impacto positivo al utilizar los renacuajos
obtenidos por la viabilidad de las ovas y que estos logren sobrevivir en la Reserva Nacional de Junín.
CONCLUSIONES
–
La viabilidad de las ovas obtenidas por estimulación hormonal
en unas pruebas previas a este estudio y presentadas en el cuadro
N° 1, mostro que el total de ovas incubadas han resultado
viables a excepción de las ovas muertas que se presentaron en un minino,
puestos que todos han sido manipulados y mantenidos en una sala de incubación simi- lar a pesar de que la dosis utilizada para la obtención de estas ovas ha sido diferentes
–
Los renacuajos obtenidos de esta incubación y que fueron
sembrados en cinco lugares distintos de la reserva nacional de
Junín, cuadro N°2, estadísticamente los lugares mencionados resultaron con diferente impacto
al sembrío de los renacuajos, primero al
obtener una grado de significancia de 0.000 menor a 0.005 lo que nos da a conocer
que los cinco lugares son diferentes; Al mismo tiempo
al hacer la comparaciones de grupos por la prueba
de tukey se determinó que en relación
al impacto en la reserva,
3 lugares son muy similares
y que presentan por pruebas
preliminares alta contaminación de re- lave minero estos puntos son 1) bordes
del lado sur del lago Chinchaycocha, 2) borde
del lado este del lago Chinchaycocha perteneciente a la Reserva Nacional
de Junín el cual es el principal
cuerpo de agua y hábitat
natural de esta especie, 3) Rio Chacachipa ubicado al lado sur, y los que presentaron mejor impacto y
buena adaptación de los renacuajos
sembrados en grado de sobrevivencia
son 4) Rio Huayre ubicado al lado este
del lago y mucho mejor el 5) Rio Huarmipuquio ubicado al lado oeste el lago mostrados
en la figura N°2, además
en campo se observó un impacto favorable
durante la introducción de
los renacuajos a sus ambientes naturales el impacto obtenido fue beneficioso para toda la población y la biodiversidad existente en la Reserva Nacional
de Junín y en el Santuario Nacional de Huayllay.
Perspectivas
–
Continuar con las
investigaciones de viabilidad de ovas obtenidas por estimulación hormonal a fin de que sea una base para
poder repoblar la Reserva Nacional de Junín,
concientizando así con respecto al valor ambiental de la Rana Gigante de
Junín a la población circundante a la
Reserva además de debe manipular otros puntos de sem- brado de renacuajos al lado Norte del lago Chinchaycocha,
continuando el monitoreo de impacto
positivo en la reserva Nacional de
Junín, con la introducción de especies manipuladas
en laboratorios
REFERENCIAS
Aguilar, C. & Valencia, N. 2009. Relaciones filogenéticas entre telmatobiinidos (Anura, Ce- ratophryidae, Telmatobiinae) de los
Andes centrales basado en la morfología de los
estados larval y adultos. Facultad de Ciencias Biológicas UNMSM.Rev.
Perú. biol. : 043- 050
Aguilar,
X. & Legorreta, G. & Casas, G. 2009. Reproducción ex situ en Ambystoma
granu- losum y Ambystoma
lermaense (Amphibia: Ambystomatidae). Acta zoológica mexi- cana. vol.25, n.3, pp. 443-454.
Amat, R. & León, L. 2008. El Cambio Climático
no tiene fronteras. Secretaria General de la Comunidad Andina. Ed.
Libélula.
Angulo, A., Sinsch, U. & Aguilar Puntriano, C. 2004. Batrachophrynus
macrostomus.
Atencio,
V. 2001. Producción de alevinos de especies nativas. Revista MVZ.Vol.6 numero 1.
Universidad de Córdova. Colombia.
Avila, A. 2000. Introducción de la Metodología de la Investigación. Ed. CONCYTEC. Pri- mera
Edición.
Becerra J. 1985. Introducción A La Ranicultura. Asociación brasileña de criadores de ranas. Edit. ABCR. 2°
Edición. Brasil. 87pp.
Bedriñana, M. 1990. Crianza y Reproducción de la
Rana. Dirección Regional de Pesquería Junín. Huancayo.
Perú.
Bedriñana, M. 1999. Informe de Actividades del Centro
Experimental de Crianza de Ranas “La Huaycha”
(Batrachophrynus Macrostomus). Dirección Regional de Pesquería- Ju- nín. Huancayo.
Browne, R. & Li, H. Seratt, J. & Kouba, A.
2006. La progesterona aumenta el número y la
calidad de la hormona inducida Fowler sapo (Bufo fowleri) ovocitos. Reproductive Biology
and Endocrinology. BioMed Central
4: 3-3.
Browne, R. & Seratt, J. &
Carrie, V. & Kouba, A. 2006. Cebado hormonales, inducción de la ovulación y la fertilización in vitro
de Wyoming en peligro el sapo (Bufo baxteri)
Reproductive Biology and Endocrinlogy. BioMed Central 4: 34-34.
Caro, C. & Quinteros, Z. & Mendoza, V. 2007. Identificación de indicadores de
conserva- ción para la reserva Nacional de Junín, Perú. Ecología Aplicada, 6(1,2)
Cabrejos, J. 1997.Crianza en el valle del Mantaro.
Dirección Regional de Pesquería Junín.
Huancayo. Perú.
Castillo, J. 2001. Tesis de Maestría, “Contaminación por Metales Pesados
en Agua Sedimen-
to y Biota del Lago Junín”:
Universidad Nacional de Trujillo.
Carrillo, O. &
Vega, F. & Nolasco, H. & Gallardo, N. 1993. Aditivos
alimentarios como es timuladores
del crecimiento de camarón Grupo de Biotecnología Marina, Cuba. Universidad de La Habana.
Chocano, L. 2005. Las zonas
altoandinas peruanas y su ictiofauna endémica. Revista Digital
Universitaria. Departamentos de Ictiología y Limnología (MHN - UNMSM)
Volumen 6 Número
8
Correa, F. 2002.
La reproducción en anfibios: interacción espermatozoide-ovocito en el sapo
B. arenarum. Becaria de Investigación, Departamento de Biología
molecular y Bioquí
mica, Universidad de Málaga
De Macedo. 1950. Anotaciones Para El Conocimiento Zoológico
Del Genero Batrachophry- nus Peters, 1873 /Amphibia Salientia). Universidad Nacional Mayor de San Marcos de Lima-
facultad de Ciencias. Lima.
Díaz, N. F. & Neira, R. 2005. Biotecnología
Aplicada a la Acuicultura. Biotecnologías clá-
sicas aplicadas a la reproducción de especies cultivadas. Departamento de Producción Animal. Facultad de Ciencias Agronómicas. Universidad de Chile.
Cien. Inv. Agr. 32(1):
45-59.
Duellman, W. & Trueb, L. 1994.
Biology of Amphibians. The Johns Hopkins University Press. 648 pp
Durham, A. 2001.
Notas biológicas. www.naturalista.virtualave.net/notas/notas06/html.(fe- brero 2003)
El Comercio. 2000.
Reinos animales. Embrión.
Mamíferos. Reptiles. Anfibios. Aves. Peces publicidad de Reproducción animal.
Área de Biología, Botánica, Genética y Zoología.
Fenerich, H. & Godinho, R. &
Brambley, J. 2010. Consideraciones sobre la determinación de dosis hormonales eficaces para la reproducción inducida
en peces fluviales de valor comercial. Instituto
de Pesca, La Acuicultura en América Latina.
São Paulo, Brasil
Frieden, E. & Lipner, H. 2003. Endocrinología de
vertebrados, www. biolo.bg.fcen.uba.ar/ enocri.html.(febrero,
3003)
Frost, D. 1985. Amphibian species
of the
world. Lawrence Allen Press, 732p.
Gonzales, A. 2002.
Reproducción. www. canalh.net/webs/sgonzales002/prodacuat/repro- duccion.htm (febrero 2003)
Harvey, J. & Hoar, WS. 1980. Teoría y práctica de la reproducción inducida en los peces.
Centro Internacional para el Desarrollo, Ottawa, Canadá.
Hernández, R. & Fernández, C. & Baptista, P. 2004. Metodología de la Investigación. Terce- ra Edición. Mc Graw Hill. México.
Hernández, R. & Fernández, C. & Baptista, P. 2010. Metodología de la Investigación. Quinta Edición. Mc Graw Hill.
México.
Houssay, A. 1930. Acción sexual
de la hipófisis en los peces y reptiles. Revista
de la Socie- dad Argentina de Biología 106:686-688.
Ibayes, F. 1997. Ciencias naturales
y exactas. www.naturales/18-A018modif-Niveles siri-
cos/anfibios/htm. (febrero
2003)
Jarrud, M. 2005. Tiempo, Clima, Agua y Desarrollo Sostenible. Organización Meteorológica Mundial. Primera Edición.
Kerlinger, F. 1998. Investigación del comportamiento animal.
Segunda Edición. Mc Graw, Will-
México
Landero,
H. & Gonzales, R. 2006. Estadística con SPAA y Metodología de la Investigación. Edit. Trillas
S.A. de C.V. Impreso en México.
Landines, M. 2002. Utilización
de hormonas en la reproducción de peces. Universidad Na- cional de Colombia-Bogotá.
Luque, F. Chávez,
J. 1999.Estadística aplicada.3ra ed. Mainini, G.
1947. La Semana Médica. Publicación 12 Mainini, G. 1950. Unidad
sapo. Publicación 15
Manyari,G. 2011. estimulación hormonal para la
reproducción en cautiverio de “Batra- chophrynus
macrostomus, “rana gigante de Junín”. Tesis para optar el grado de Ma- gister en Biotecnología Reproductiva
Mejía, L. & Rodríguez, C. & López, J. 2009. Evaluación
de la Gonadotropina Coriónica Humana (HCG) a diferentes dosis, en la reproducción inducida
de pargo lunarejo
(Lut- janus guttatus,
Stendaichner 1869) en condiciones de cautiverio. Departamento de Re- cursos
Hidrobiológicos, Programa de Ingeniería en Producción Acuícola,
Universidad de Nariño,
Nariño, Colombia
Mojica, B. 2002. Efecto
de LHRHa2 combinada con Domperidone (método Linpe) y de la Hipófisis de Carpa (HC), en la maduración final y ovulación de Curimbatá Prochilodus scrofa (Stendachner, 1881) (Pisces: Characidae) Estación
Piscícola La Terraza.
Institu- to Nacional
de Pesca y Acuicultura INPA. Colombia
Monroy, J. Orozco, F.1974. El desarrollo de forma y patrones en animales. www.lafacu.com/ apuntes/biologia/la_reproduccion/default.htm.
(febrero 2003)
Moore K. &
Persaud T.. 2009 Embriología clínica Morín, E. (1982). El Método III.
El conocimiento del conocimiento. Catedra: Madrid. Munibe, A. 1994. Biología reproductiva de la rana ágil, Rana dalmatina (Ranidae,
Anura), en Navarra. Ciencias Naturales - Natur Zientziak) Nº 46 97-108
San Sebastián –Es- paña
Muñoz, J. 2009. Control Hormonal
de la reproducción en peces.
Departamento de Biología.
Facultad de Ciencias del Mar y
Ambientales. Universidad de Cádiz. Polígono Río San Pedro.
España.
Órganon U.S.A. 2006. Pregnyl. Baxter
Pharmaceutical Solutions
Ortega, l. & Rodríguez, C. 2004. Evaluación comparativa del efecto del extracto pituitario de carpa (EPC) y gonadotropina corionica humana (hCG) en la reproducción inducida
del bagre del patia (rhamdia
quelen) en condiciones de cautiverio Tesis de grado. Facultad de Ciencias Pecuarias. Universidad de Nariño.
Pasto-Colombia
Pérez, M. & Ruiz, L. 2000. Métodos
Estadísticos de Investigación en las Ciencias
Sociales. Edit. AC.
Primera Edición. Madrid-España.
Portillo, L. & Roque, C. 2003. Metodología de la Investigación. Juan Gutemberg Editores
Impresores. Primera Edición. Lima – Perú.
Pomachagua, P. (2010). Derecho Ambiental y Enfoque Axiológico
sobre el Medio Ambien- te. Perú:
Rumy.
Puente, F. 1990. Huevos y larvas
de anfibios. Universidad Nacional Mayor de San Marcos.
Reynalte, D. & Esquivel, B. & Esquivel,
E. & Zaniboni, E. 2002. Reproducción inducida del Piauçu, leporinus macrocephalus Garavello
y Britski, 1988. (Characiformes, Anosto- midae. Boletim do Instituto da Pesca, São Paulo
Rodríguez, L. & Cordova, J. & Icochea, J.
1993. Lista preliminar de los anfibios del Perú. Publicaciones del Museo de Historia Natural. Universidad
Nacional Mayor de San Marcos 45:1-22.
Rodríguez, S. 1994. Investigación Científica Teoría y Métodos. Pacifico
Editores. Perú.
Roe, C. 1950. Estandarización de la unidad
sapo en el dosaje de Gonadotrofinas Corionicas. Sección Bioquímica del Departamento de Investigaciones Médicas
del Instituto de Higiene y Salud
Publica de Lima.
Rozas, P. La Rana Grande
Chilena (Caudiverbera caudiverbera) Recurso natural escaso uni- versidad de los Lagos Departamento de Recursos Naturales
y Medio Ambiente
Somerville, C. & Briscoe,
J. 2000. Genetic
engineering and water
Tamayo, S. & Tamayo, A. 1999. El Proceso de la Investigación. Limusa Noriega Editores. Tercera Edición. México.
Tovar, A. 2006. Estatus de la rana de Junín,
Batrachophrynus macrostomus Peters 1873 (Anura: Leptodactylidae: Telmatobiinae) en el Lago Junín, Perú.
Uipan, P. & Sisniegas, H. & Valdivia, M. 2006.
Inducción de ovulación y fertilización in vitro en Bufo marinus.
Universidad Nacional mayor de San Marcos. Facultad
de Cien- cias Biológicas.
Instituto de Investigación de Ciencias Biológicas Antonio Raymondi. Lima-Perú.
Valdebenito, I. 2008. Terapias hormonales utilizadas
en el control artificial de la madurez sexual
en peces de cultivo: una revisión. Centro
de Genómica Nutricional Agroacuíco- la
Escuela de Acuicultura, Universidad Católica de Temuco, Temuco, Chile. CGNA. Arch Med Vet 40,
115-123
Vargas, G. 1996. Control de la calidad
del agua en la red de distribución. CEPIS. Lima - Peru
Vaske, J. & Kobrin, K. 2001. Place attachment
and environmentally responsable behavior. Journal of Environmental Education. 32.
Vera, I. 2004.
La Reserva
Nacional de Junín en Emergencia Ambiental. ParksWatch-Perú.
Vinatea. 1990. Manual de reproducción de peces Colossoma
sp, “pacu” y “tambaqui” .sobre
inducción final de maduración, ovulación y espermiacion en peces
cultivados.
Vizcarra, A. 2002. Ecósfera la Ciencia Ambiental y los Desastres
Ecológicos. Primera edi- ción.
Yarlequé, Ch.; Javier,
A.; Monroe, A.; y Nuñez (2007). Investigación en Educación y Cien- cias
Sociales. Perú.
Zohar, Y. & Mylonas, C. 2001. Endocrine manipulations of spawning in cultured fish: from hormones to genes. Aquaculture 197, 99-136
 Kanyú, Revista
Científica Universidad Nacional Autónoma Altoandina de Tarma
Kanyú, Revista
Científica Universidad Nacional Autónoma Altoandina de Tarma